化学
次亜塩素酸
IUPAC名 : 次亜塩素酸、塩素(I)酸、クロラノール、ヒドロキシドクロリン
他の名前 : 次亜塩素酸水素塩、水酸化塩素、電解水、電解酸化水、電気活性水
CAS番号 : 7790-92-3
モル質量 : 52.46 g/mol
分子式 : HOCl
外観 : 無色水溶液
水への溶解性 : 溶解可能
酸度 : 7.53
電解
化学および製造業において、電気分解とは、非自発的化学反応を駆動するために直流(DC)を使用する技術をいいます。 電気分解は、自然発生する資源から元素を分離するプロセスとして商業的に重要であるとされています。 次亜塩素酸を生成するためには、塩化ナトリウム(NaCl)および水(H2O)の電解を用いることができます。 電気分解技術は、1830年代に電気分解の法則を開発したMichael Farradayによって最初に発表されました。 塩水溶液中の2つの電極間に電流を流すと、塩素ガス、 次亜塩素酸ナトリウム(漂白剤またはNaOCl)、次亜塩素酸、水酸化ナトリウム、水素ガス、オゾン、および微量の他の新生酸化剤が生成されます。
電気分解の重要なプロセスは、外部回路からの電子の除去または添加による原子とイオンの相互交換です。 電解液に浸された一対の電極間に電位が追加されます。各電極は反対の電荷のイオンを引きつけます。 正に荷電したイオン(陽イオン)は電子供給(陰)カソードに向かって移動します。負に帯電したイオン(陰イオン)は、電子抽出(正)アノードに向かって移動します。 化学において、電子の損失は酸化と呼ばれ、電子利得は還元と呼ばれます。
例えば、次亜塩素酸を製造する最初の工程は、水素と塩素を生成する塩水の電気分解であり、生成物は気体となって発生します。 これらの気体生成物は、電解液から泡立ち、回収されます。
2 NaCl(s) + 2 H20(l) → 2 NaOH(aq) + H2(g) + Cl2(g)
膜細胞技術
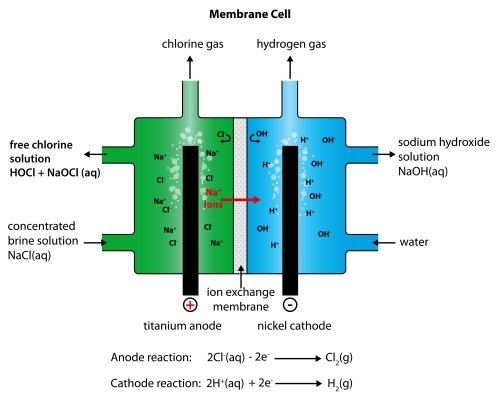
イオン交換膜は、陽イオンのみを通過させるポリマーから作られます。 これは、塩化ナトリウム溶液からナトリウムイオンだけが膜を通過でき、塩化物イオンは通過できないことを意味します。 この事の利点は、右側区画に形成される水酸化ナトリウム溶液は、決して塩化ナトリウム溶液で満たされる事がないということです。 使用される塩化ナトリウム溶液は純粋でなければなりません。それが他の金属イオンを含んでいる場合、これらも膜を通過し、水酸化ナトリウム溶液を汚染することとなります。
水素はカソードで生成されます。 :
2H+(aq) + 2e- → H2(g)
水酸化ナトリウムもカソードで生成されます。 :
Na+(aq) + OH-(aq) → NaOH(aq)
塩素はアノードで生成されます。 :
2Cl-(aq) - 2e- → Cl2(g)
また、この時、化学反応により、いくらかの酸素で汚染されることとなります。 :
4OH-(aq) - 4e- → 2H2O(l) + O2(g)
塩素を水に添加すると塩酸(HCl)と次亜塩素酸(HOCl)の両方が得られます。 :
Cl2(g) + H2O ⇌ HOCl(aq) + HCl(aq)
Cl2(g) + 4 OH− ⇌ 2 ClO-(aq) + 2 H2O(l) + 2 e−
Cl2(g) + 2 e− ⇌ 2 Cl-(aq)
pHは、水溶液中に存在する遊離塩素種を決定する要素となります。 5〜6のpHでは、塩素種はほぼ100%次亜塩素酸(HOCl)となります。 pHが5以下に下がると、Cl2(塩素ガス)に変換し始めます。 pH6より上では、次亜塩素酸イオン(OCl-)に変換し始めます。

次亜塩素酸は、弱酸(約7.5のpKa)であり、これは式で示されるように、水素および次亜塩素酸イオンにわずかに解離することを意味します。 : HOCl ⇌ H+ + OCl-
pH6.5~8.5の間では、この解離は不完全であり、HOClおよびOCl-種の両方がある程度存在します。 pHが6.5未満では、HOClの解離は起こらず、pHが8.5を超えると、OCl-への完全な解離が起こります。
HOClの殺菌効果はOCl-よりもはるかに高いので、より低いpHでの塩素化が好ましいとされます。 また、次亜塩素酸(HOCl)の殺菌効率は、次亜塩素酸イオン(OCl-)の殺菌効率よりもずっと高いとされています。 HOClとOCl-との間の塩素種の分布は、上述のようにpHによって決定されます。
HOClは低いpHで優勢であるため、塩素処理は低いpHでより効果的な消毒効果を発揮します。 高いpHでは、OCl-が優勢であり、これは消毒効率を低下させます。
細菌の不活性化
塩素は、細菌を不活性化するための極めて有効な消毒剤であるとされています。 1940年代に実施された研究では、大腸菌、緑膿菌、チフス菌、および赤痢菌に対する不活性化レベルが時間的な関数に関連付けて調査されました。 (Butterfield et al., 1943). 研究結果では、HOClがこれらの細菌の不活性化のためにOCl-より有効であることが分かりました。 これらの結果は、何人かの研究者によって、細菌を不活性化するのにHOClがOClよりも70〜80倍有効であることが確認されたことで知られています。 (Culp/Wesner/Culp, 1986). 1986年以降、HOClがOClよりも優れていることが書かれた出版物が何百も発行されています。 (研究データベースを閲覧 ).
最大の課題は、塩素ガスまたは次亜塩素酸塩の代わりに中性のpHで次亜塩素酸を安定した状態で生成できるようにすることでした。 次亜塩素酸は準安定な分子です。それは塩水に戻ったり、次亜塩素酸塩に変換する可能性があります。
単一細胞技術
最も大きな進歩の1つは、水酸化ナトリウム(NaOH)の副産物なしに遊離塩素の単一の流れが生成される単一細胞技術の開発でした。 この技術は、次亜塩素酸のより安定した溶液の開発をもたらし、生成された遊離塩素のpHに対するより大きな制御が可能となりました。 水のpHは世界中の地域における供給源によって異なるため 塩水のpHを変化させることにより、pH5〜7の間で次亜塩素酸(HOCl)を多く占有する遊離塩素溶液を生成する場合、より大きな制御および一貫性を保つことが可能となります。

陽極反応 :
2Cl-(l) → Cl2(g) + 2e-
陰極反応 :
2H2O(l) + 2e- → H2(g) + 2OH- (aq)
遊離塩素の生成 :
Cl2 (g) + H2O → HOCl + HCl
Cl2 (g) + 2OH-(aq) → OCl- (aq) + Cl-(aq) + H2O(l)
Best Hypochlorous Acid (HOCL) Generators
 Portable Hypochlorous Acid (HOCL) Machine
Portable Hypochlorous Acid (HOCL) Machine
Make high quality hypochlorous acid in the home or office.
$159.99 + Free Shipping
 HOCL Machine + Electrostatic Sprayer
HOCL Machine + Electrostatic Sprayer
Make hypochlorous acid and spray with an electrostatic cold fogger.
$309.98 + Free Shipping


